在保养水质检测仪的电极时缓冲液是必须要准备的物品。它最常用的功能就是保持电极校准溶液的性质不会出现变化,比如在校准PH电极时就必须要用到它。该溶液通常由弱碱和其共轭酸(或弱酸及其共轭碱)组成,例如校准水质检测仪的ph电极时这种溶液可以平衡酸碱度。这样就能更好的控制ph反应,简单的来说缓冲溶液是即使加入少量酸/碱后也能时pH值不变的溶液。今天我们主要想为大家介绍校准ph电极时缓冲液的工作原理。
碱缓冲液的作用:碱性缓冲液含有弱碱(BOH)及其与强酸(BX)的盐。因此,除了H3O +和OH-之外,缓冲溶液含有大量的弱碱性BOH和阳离子B +(来自盐BX的离解)。
向碱性缓冲液中加入酸或碱导致下列反应:
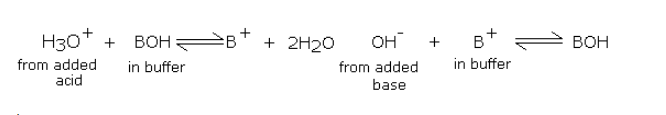
在校准水质检测仪的ph电极时,缓冲溶液中加入酸或碱确实引起缓冲酸(或碱)和盐的浓度变化,但由于缓冲溶液中这些浓度相对高得多,所以缓冲液的酸或碱的比例不会出现变化。
酸性缓冲液的作用:酸性缓冲液含有相对大量的弱酸(HA)及其盐与强碱(如NaA)。因此,除了H3O +和OH-以外,缓冲溶液含有大量的HA和A-(由于盐的离解)。
加入少量强酸会引起反应,
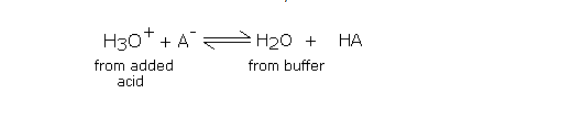
以等量的>A与H3O +结合得到相同量的未离解的弱酸HA的方向进行。因此,加入的酸被缓冲液中高浓度的阴离子(来自盐)吸收。只要添加的强酸量较少,盐浓度和弱酸(HA)的浓度变化就很小。因此,通过向缓冲溶液中加入强酸,酸与盐的比例不会明显变化。
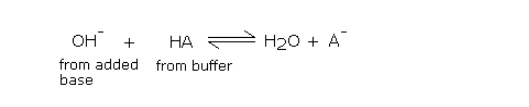
以正向进行添加,能导致以缓冲酸为代价形成等量的盐。只要加入很小的碱量,弱酸与盐的比例就基本保持不变,而pH值的的变化基本不会太大。
以上就是校准ph电极时缓冲液的工作原理,大家在了解之后可以多加利用。
上一篇:操作PH水质检测仪时六个技术提示